55503683
Redoxreaktionen
Chemie 7, Vol. 1
In unserem Arbeitsheft Chemie 7, Vol. 1 – Redoxreaktionen finden Sie 50 interaktive und didaktisch aufbereitete Aufgaben. Das Medium bietet H5P-Aufgaben an, die ohne zusätzliche Software verwendbar sind. Das Medium enthält interaktive Videos und 50 H5P-Aufgaben zum Thema Redoxreaktionen. Durch interaktive Aufgabentypen wird das audiovisuelle und interaktive Lernen einfach. Lernen macht jetzt Spaß!
Beinhaltete Aufgaben
- 1. Einstieg - Redoxreaktionen - Interaktive Aufgaben
- 2. Oxidation oder Reduktion? - Interaktive Aufgaben
- 3. Oxidation und Reduktion finden gemeinsam statt - Interaktive Aufgaben
- 4. Reduktion und Oxidation - Begriffe Zuordnen - Interaktive Aufgaben
- 5. Verbrennung von Methan - Interaktive Aufgaben
- 6. Redoxreaktionen im Alltag - Interaktive Aufgaben
- 7. Redox und Elektronentransfer - Interaktive Aufgaben
- 8. Schreiben von Halbgleichungen - Interaktive Aufgaben
- 9. Reaktion zwischen Natrium und Chlor - Interaktive Aufgaben
- 10. Reaktion zwischen Chlor und Kaliumbromid - Interaktive Aufgaben
- 11. Was bedeutet Oxidationszahl? - Interaktive Aufgaben
- 12. Oxidationszahlen in Verbindungen - Interaktive Aufgaben
- 13. Oxidationszahlen in Formeln - Interaktive Aufgaben
- 14. Oxidationszahlen in Redoxreaktionen - Interaktive Aufgaben
- 15. Änderungen in Oxidationszahlen - Interaktive Aufgaben
- 16. Chemische Formeln überprüfen - Interaktive Aufgaben
- 17. Redoxreaktionen - Reflexion - Interaktive Aufgaben
- 18. Redox oder nicht? - Interaktive Aufgaben
- 19. Reaktion von Wasserstoff mit Sauerstoff - Interaktive Aufgaben
- 20. Korrosion - Interaktive Aufgabe
- 21. Das Dach des Berliner Doms - Interaktive Aufgaben
- 22. Oxidationszahl 0 - Interaktive Aufgaben
- 23. Finde die Oxidationszahlen heraus! - Interaktive Aufgaben
- 24. Oxidation oder Reduktion? - Interaktive Aufgaben
- 25. Kupfersulfid - Interaktive Aufgaben
- 26. Das Periodensystem und Oxidation - Interaktive Aufgaben
- 27. Redoxreaktionen im engeren Sinn - Interaktive Aufgaben
- 28. Redoxreaktionen im erweiterten Sinn - Interaktive Aufgaben
- 29. Elektronentransfer - Magnesium und Chlor - Interaktive Aufgaben
- 30. Was sind Oxidations- und Reduktionsmittel? - Interaktive Aufgaben
- 31. Oxidations- und Reduktionsmittel im Labor - Interaktive Aufgaben
- 32. Kaliumdichromat: Ein Oxidationsmittel - Interaktive Aufgaben
- 33. Kaliumpermanganat: Ein Oxidationsmittel - Interaktive Aufgaben
- 34. Alkoholtest - Interaktive Aufgaben
- 35. Kaliumiodid - Interaktive Aufgaben
- 36. Finde das Reduktionsmittel - Interaktive Aufgaben
- 37. Finde das Oxidationsmittel - Interaktive Aufgaben
- 38. Chlor und Natriumbromid - Interaktive Aufgaben
- 39. Iod in Algen - Interaktive Aufgaben
- 40. Eisen in den Eisentabletten - Interaktive Aufgaben
- 41. Reaktion zwischen Kohlenstoff und Kupferoxid - Interaktives Video
- 42. Kaliumsalz der Chromsäure - Interaktive Aufgaben
- 43. Silberchlorid - Interaktive Aufgaben
- 44. Die Redoxreihe der Metalle - Interaktive Aufgaben
- 45. Unedle und edle Metalle - Interaktive Aufgaben
- 46. Metalle im Wettbewerb - Interaktive Aufgaben
- 47. Welches Metall ist reaktiver? - Interaktive Aufgaben
- 48. Magnesium und Kupferoxid - Interaktive Aufgaben
- 49. Verkupfern - Interaktive Aufgaben
- 50. Die Redoxreihe rekonstruieren - Interaktive Aufgaben
Lehrplanzentral und an den Bildungsstandards orientiert
Passend dazu
Plastik
Sie basieren auf Kohlenstoffverbindungen, sind preiswert, gut formbar und in den vielfältigsten Erscheinungsformen vorhanden.
Feuer und Flamme
Feuer – es schenkt uns Wärme und Licht, vermittelt Geborgenheit und fasziniert uns mit seinen tanzenden Flammen. Aber Feuer ist auch bedrohlich. Ungezähmt verbreitet es Gefahr und Zerstörung.
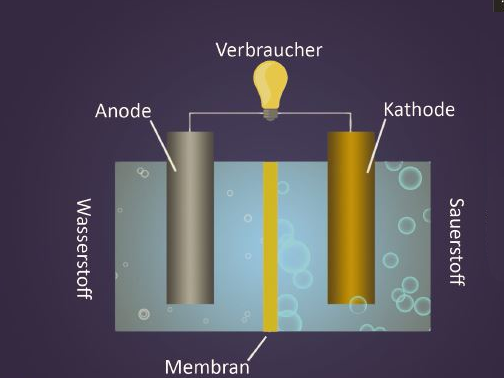
Brennstoffzelle
Die Brennstoffzelle ist keine neue Erfindung, sondern wurde bereits 1839 vom britischen Physiker Sir William Robert Grove vorgestellt. Ihr Wirkprinzip der kalten Verbrennung entspricht einer Umkehrung der Elektrolyse. In der Vergangenheit wegen ihrer Komplexität nicht umsetzbar, rückt die Brennstoffzellentechnologie heute, mit der Energiewende und der Suche nach umweltfreundlichen Energien, erneut in den Fokus.